他業界を巻き込んだ一大事件でしたが、2021/04/16に調査結果報告書が発表されました。
原因が詳細に記載された文章です。メチャメチャ気になりますよね!
※調査結果報告書


- 何が問題だったのか?
- 調査結果で製薬会社の社員が気になることは何か?
この辺りに着目してまとめていきます。

調査体制
まずは誰が調査したのか確認します。
ちょっとズレますが面白いのでご確認ください。


第 2 調査体制
当委員会の構成員は、以下のとおりである。
清原 孝雄(薬学博士・元独立行政法人医薬品医療機器総合機構専門委員)
三村 まり子(西村あさひ法律事務所 弁護士)
平尾 覚(西村あさひ法律事務所 弁護士)
当委員会による調査に当たっては、西村あさひ法律事務所所属の弁護士 13 名が、その補助に当たった。
引用:調査結果報告書
清原 孝雄さんって誰やねん?って思ったのですが、PMDAのOBで化血研問題の時の運営委員も勤めた方でした。
要は医薬品産業の不正のスペシャリストっぽいです。
西村あさひ法律事務所は弁護士事務所の最大手ですね。


・2005年-2009年 GEヘルスケア・ジャパン株式会社 執行役員 兼 法務本部長・2008年-2009年 日本メジフィジックス株式会社 非常勤監査役・2010年-2015年 ノバルティスホールディングジャパン株式会社 取締役 兼 法務知的財産統括 部長・2010年-2015年 ノバルティスファーマ株式会社 執行役員 兼 ジェネラルカウンセル・2015年-2018年 グラクソ・スミスクライン株式会社 取締役引用:西村あさひ法律相談事務所:略歴URL

続いて平尾 覚弁護士の略歴も確認したところ、
コチラの方は製薬業界と繋がりが深いという印象は受けませんでしたが(※平尾 覚弁護士略歴)
日経新聞の2020年に活躍した弁護士ランキング、危機管理分野総合4位という実績が確認されました!


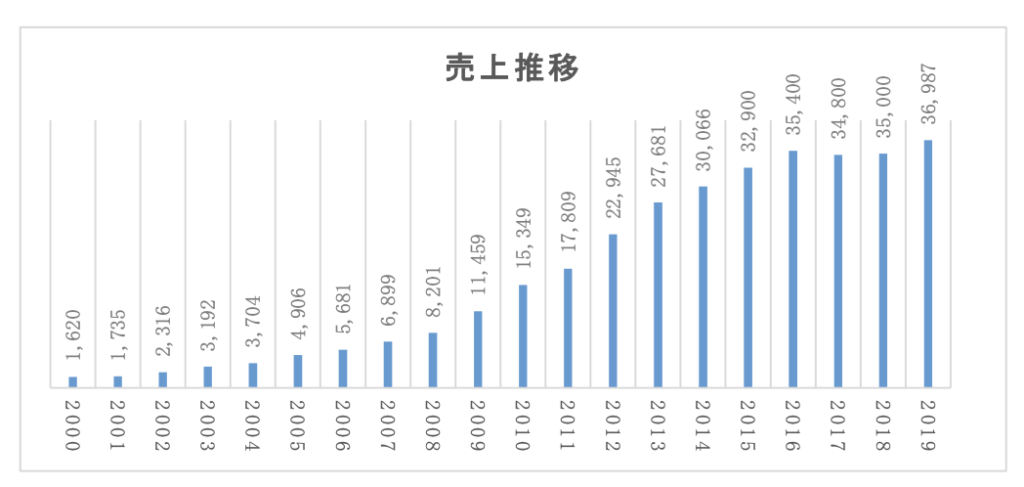
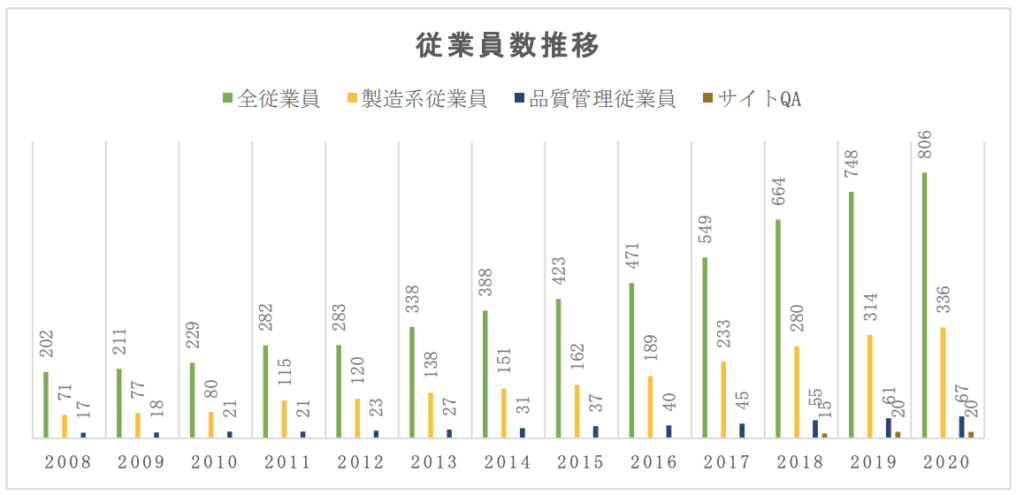
売り上げ推移と従業員数
最初に目についたのが売り上げ推移と従業員数です。
※単位は百万円
引用:調査結果報告書
2008年の売り上げは82億、2019年は370億:4.5倍
2008年の品質管理従業員数は17人、2019年は61人:3.5倍
2018年からサイトQAが誕生しているのでそれを加えた81人で考えると4.7倍
と大体、等倍でしか増えていないんですよね。
等倍でいいじゃん!!と思われるかもしれませんが、QA業務が増え高度化している&増えた人員管理のためのマネージャーの存在を考慮すると等倍で言い訳がなく…
まぁこの部分は正直明るくないので断言はできませんけど、医薬品の高度化や品質保証という業態を考えると生産部門ほど量を活かした効率化はしにくいだろうと考えると単純に人少なくない?とは感じました。
実際、報告書を読み進めて行くと
受注量の増加に従って、製造部門の人員の増強も図られてはおり、小林化工 の製造系従業員の数は、2016 年から 2020 年にかけて、189 名から 336 名へと増強されてい る。
もっとも、人員の増強は計画的に行われていたわけではなく、販売目標が設定される と、それに必要な製造部門の人員を増強するという後追いの対応が取られているに過ぎなかった。言うまでもなく、入社したての従業員が戦力となるには、相当程度の期間が必要 であり、また十分なGMP教育を施す必要がある。
しかし、小林化工においては、計画的な 人員増強が行われておらず、十分な教育や訓練を施すことのないまま、製造現場に投入す ることが繰り返される状況にあった。
引用:調査結果報告書
品質管理従業員の人員推移を見ると、2008 年 4 月には 17 人であったのが、その後 人員数が増加し、2020 年 4 月には 67 名の人員を抱えるに至っており、ここ 10 年余りで人員は急拡大しているが、製造部と同様、その人員数は、矢地事業所品質管理部の業務をまかなえるだけのレベルには達していないと思われる。
品質管理部が人員及び業務負荷の観点から問題を抱えていることは、戦略会議の場でも 度々議論の対象になっている。
小林化工は、品質管理部の人材採用に努めてきたが、品質 管理の知見・技能を有する人材の確保は思うように進んでこなかった。
引用:調査結果報告書

現場フロー
承認書と異なる製造方法が「現場フロー」というものに記載されていました。
承認方法と違う方法で作っていたというのは過去記事で紹介した通りですね!
医薬品は国に提出した承認書と全く同じ方法で作らなければなりません。
これが行われていない医薬品は基本的にはありません。
ちょっとでも手順を変えると予期しない物質が生まれたり保存ができなくなったりする可能性があります。


- イトラコナゾール5kg→5.35kg
- 未記載→エチルセルロース追加
- ヒプロメロース6.5kg→5.9kg
- メタケイ酸アルミン酸マグネシウム0.3kg→0.156kg
- エタノール/ジクロロメタン混液115kg→92.28kg


作業者は、自らの担当する作業が終了した後、工程管理室等において、製造指 図・記録書に作業結果を記録していたが、実際の製造実態を反映した数値等を記載していたわけではなかった。今般睡眠剤が混入したロット番号 T0EG08 の製造指図・記録書には、秤量工程において秤量したイトラコナゾールの量について、承認書に記載されたのと 同じ数量(5kg)を秤量した旨の記載がなされている。しかし、実際には承認書とは齟齬する量(5.35kg)が秤量されていた。引用:調査結果報告書


不正できないように電子化してないの?と思う方もいらっしゃると思うのですが、
ちゃんと電子化されています…
秤量を行う際に使用する秤量器には印刷機能が備わっており、秤量後に印刷ボタンを押 すことで秤量した記録が印刷される。
そして、製造指図・記録書には、印刷された秤量記 録を添付することとされていた。
秤量を担当する作業者は、例えば、イトラコナゾール 50mg については 5kg を秤量した時点で印刷ボタンを押して秤量結果を印刷し、その後 0.3kg を追加して実際の秤量を完了していた。
引用:調査結果報告書
システムをちゃんと作っても介入する余地を残してしまうと使う人次第でどうとでもなる好例ですね…
性悪説に基づいてシステムを組むときは介入の余地がないほどガチガチにしなければいけないのでしょうね。
混入の経緯のまとめ
ここからは混入の経緯と原因が詳しく記載されていました。

直接の原因:取り違え
直接の原因はイトラコナゾールとリルマザホンの原料の取り間違えというのはこれまで報道された通りです。
ただなぜ取り間違えたのか?ということに関しては明確にはならなかった様です。
なぜ作業者がイトラコナゾールとリルマザホン塩酸塩水和物を取り違えたのかについては、その理由は判然としない。
イトラコナゾールとリルマザホン塩酸塩水和物 の容器の外観は明らかに異なる上、容器の表面には、原料名が明記されたシールが付されており、作業者がイトラコナゾールを取り出すことを明確に意識しながら作業をしてい れば取り違える可能性は極めて低いと考えられる。
作業者が散漫に作業をした結果、取り違えが生じた可能性が窺われるが、当該作業者は、端数原料保管室内から誤ってリルマ ザホン塩酸塩水和物を持ち出した状況について具体的に記憶をしていない。
引用:調査結果報告書
ただ、睡眠剤であるリルマザホン塩酸塩水和物が 誤って投入されたことは、現場フローに記録されていた模様で、記載があるにもかかわらずセーフティーバーが作動せず見逃されてしまったことは非常に残念です。

ダブルチェック体制の不備
本来ダブルチェックするべき作業でしたが、慢性的な人員不足でダブルチェックがなされていませんでした。

2020 年 6 月からは、ダブルチェックを行う担当者が固定されたが、そもそも人員体制として二人一組で作業することは困難 であったため、その後もダブルチェックは徹底されず、特に作業者が少なくなる夜間はダブルチェックが行われないことが多かった。
引用:調査結果報告書
んで秤量工程については、秤量された原料について、製造指図・記録書のロット及び秤取量(重量)の記載に間違いがないか確認する従業員がいたみたいなのんですが、これも人員不足で機能していなかった様です。
確認を担当していた従業員は、秤量工程を担当する作業者による秤量の確認を行うだけで手一杯な状況にあり、後混合工程における秤量の確認は実施していな かった。
引用:調査結果報告書
ここまでをまとめると、
コンプライアンスのかけらもない生産方法に加えて現場の人員不足による確認ミスで通常では考えられない製品が製造されてしまった。
という感じでしょうか。
現場フローを作ってしまった理由
なんで現場フローなんか作ってしまったかというと…
承認書と齟齬する製造が行われるようになった経緯は製品によってさまざまであるが、多くの製品は、承認書どおりの方法では製造が困難であるために、製造方法を変更し、本来であれば、一変申請等の手続を踏むべきであるのにそれを行わなかったことにより、承認書と齟齬する製造が行われるようになっている。
引用:調査結果報告書
つまり製造量を増やす為であったり、より効率化を目指して製造方法を変えた訳ですね。
本来なら手続きするはずが、それを行わず、勝手に製造を続けた訳です。
この辺は昔あった化血研問題と同じですね。


教育の不備
過去記事でもコンプライアンス意識が終わっているとは言い続けて来ましたが、
実際、教育が十二分に行われていたとは言い難いようです。
こういった教育の不備も現場フロー作成に繋がったのでしょう。
小林化工では、従業員に対して十分な GMP 教育が実施されていたとは言えない。むし ろ、「貧弱」と表現するのが妥当な状況であった。
〜中略〜
2018年以降、小林化工では、GMP教育の体制を整えてはいるが、その内実 は、必ずしも現場の従業員にまで教育が徹底されているとは言い難いものであった。 実際、アンケート調査においては、回答者 638 名中の内 488 名もの回答者が、「あなた は、当社において、十分な GMP 教育が行われていると思いますか。」という質問に対し て、「思わない」と回答している。
引用:調査結果報告書

品質保証部門の見逃し
異常な製品が製造されても品質チェックする品質保証部門が正常に機能していれば、異常は検知されますよね!
しかしながら、小林化工ではそれがなされませんでした。

再試験が別の方法で行わえれた
ここ闇が深いと思いましたね…以下引用をご確認ください。
ロット番号 T0EG08 の定量試験では、初回試験においてバルク品で規格値を逸脱する結果が出ている。その後、バルク品を対象に初期調査を行ったところ、規格値を充足する結果が得られ、その後、バルク品を対象として実施された再試験においても規格値を充足する結果が得られた。そのため、初回試験は、試験室エラー、すなわち製品に問題があるの ではなく、試験の方法に問題があったことにより規格値を逸脱した結果が出たものと結論 付けられた。 初回試験は、比較的経験の浅い試験者によって実施されたが、初期調査及び再試験は、 それよりも年次が上で試験経験の豊富な試験者が実施した。
もっとも、初回の試験方法と初回調査及び再試験の方法は、以下のとおり異なっていた。
引用:調査結果報告書
端折ってまとめると
経験の浅い試験者が初回試験で異常を検知▶️経験豊富な試験者に交代▶️初期調査で適合▶️再試験でも適合
なので最初の試験が間違っていると結論づけたが、初回の試験方法と初回調査及び再試験の方法はちがっている…
初回の試験方法と初回調査及び再試験の方法はちがっている…

引用:調査結果報告書

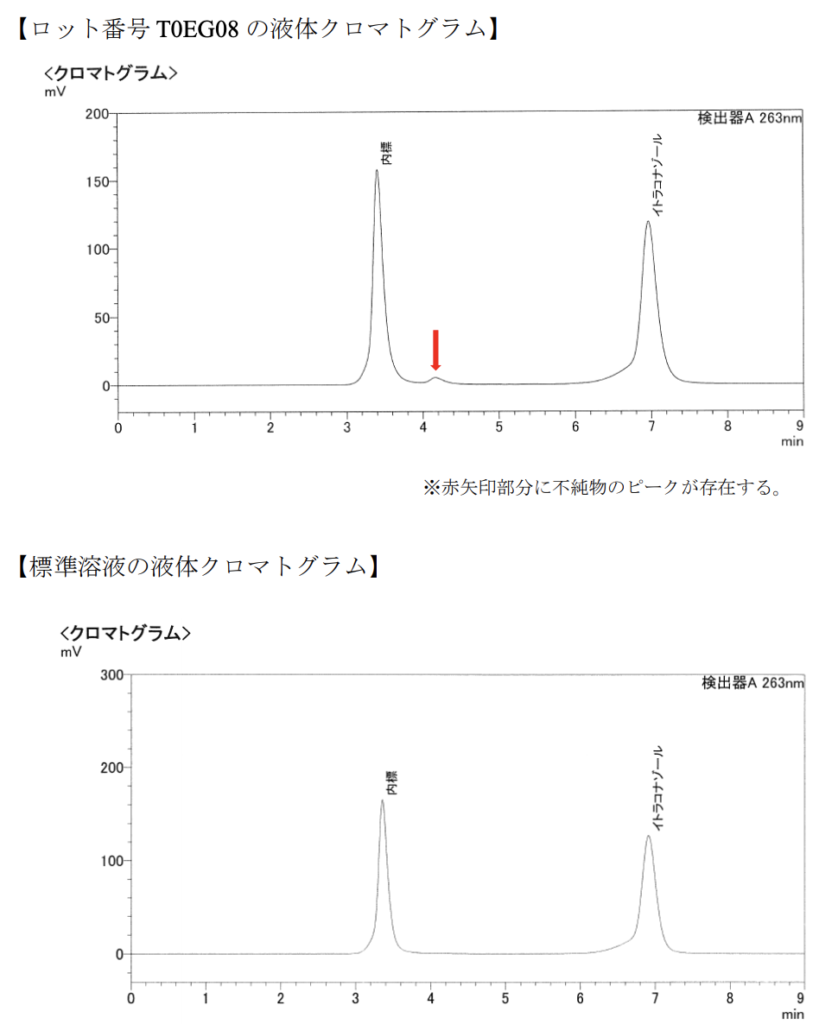
初回試験を実施した試験者は、含量が逸脱したことに気を取られ、異常なピー クの存在には気付いていないが、初期調査及び再試験を実施した試験者は、異常なピークの存在に気付いていた。
しかし、異常なピークの存在について報告を受けた試験実施責任者は、①ピークが小さいため、試験器具由来ものであり、異物が入っていても微量であると思われた、②定量試験測定結果の解析パラメーターに照らすと、試験者の指摘した ピークは、ピークではないと判断できる程度のものであったことなどから、問題はないものと判断し、ロット番号 T0EG08 は定量試験に合格した。引用:調査結果報告書


品質管理部関係者の多くは、ヒアリングにおいて、品質管理部の試験でロットアウトを 出してはならないという雰囲気が存在していたなどと述べ、試験で規格外の結果が出た場合でも、上長から試験室エラーとして再試験を実施するように指示され、それに従ってい たと述べている。
中には、品質管理部に配属された当初は、自分のミスではないと思い、 抵抗感を覚えたものの、再試験を繰り返し指示されるうちに、自分のミスではないと思い つつも、試験室エラーとして処理することに抵抗を感じなくなっていたと述べる者もい る。
引用:調査結果報告書

他にもこんな記載もありまして…
小林化工に おいて、有効期間内の出荷済み全製品につき、過去の品質管理試験の記録を確認したところ、17,042 件の試験のうち、初回試験において規格逸脱の結果が出たために再試験が実施 された製品ロットは 271 件存在した。
そのうち、24 件の試験については、初回試験において規格不適合の結果が出たにもかか わらず、初期調査を実施せず、そのまま再試験を行い、再試験において規格適合との結果が出たことから合格としているが、いずれも調査を行わずに再試験を実施することを正当化するだけの根拠は見当たらなかった。
〜中略〜
このほか、初回試験において規格逸脱の結果が出たために再試験が実施された製品ロッ ト 271 件のうち、126 件については、初回試験で規格不適合の結果が出た後、一応調査は 実施されているものの、調査が十分に行われていたとは言い難く、試験室エラーがあった と判断する根拠に乏しいまま再試験が実施されていた。
また、10 件については、再試験においては、初回試験とは異なる条件で試験が実施され ていた。 以上のように、初回試験において規格逸脱の結果が出たために再試験が実施された製品ロット 271 件のうち、合計 160 件の試験については、適切な方法で試験が実施されていな いと考えられた1
引用:調査結果報告書
160/271 件で適切な試験が行われていませんでした。
59%6割未満ですのであらゆる試験でも落ちる基準ですね!!

この他にも
試験日の改竄や結果の破棄などが日常的に行われていたようです。
文末にこんな記載がありましたが品質保証部門の問題点は、これが全てです。
品質管理部においては、初回の試験で規格不適合の結果が出た場合であっても、本来実施すべき調査を実施せず、又は十分な調査を行うことなく、安易に試験室エラーであると結論付け、再試験を実施することが往々にしてあった。
引用:調査結果報告書

仕事してませんでした!ってことですかね?
忘れちゃいけないこと
ここまで現場と品質保証の問題を確認してきた訳ですが、
組織として非常に多くの問題があるのは明確です。
しかしながら、みなさんは問題発覚後の社長の発言を覚えているでしょうか?
当時の社長の会見の意訳は
人為的な問題、ヒューマンエラーです。申し訳ありません。(意訳)
というものでした!!つまり現場に責任をマルっと押し付け組織の問題ではない!と言い切ったとも捉えられる発言です。
今回の事件は明らかにヒューマンエラーではありません。
報告書にも以下記載があります。
水虫薬と睡眠剤の取り違えは、それ自体を表面的に見れば、「ヒューマンエラー」と評価 できるかもしれない。しかし、取違えが起きた原因を考えるならば、それは決して 「ヒューマンエラー」と評価すべきものではない。承認書と齟齬した製造が放置され、また 手順が管理されていない状態が放置されていたが故に発生した事故と評価するのが相当で ある。
引用:調査結果報告書
私はどうしても現場に全ての責任を押し付けようとした社長の発言を許すことができません。

回収に至る経緯
これに関しては私が直接関わりうる業務ということで時系列でまとめて確認してみます。
- 2020 年11月24日:共同販売元のMeiji Seika ファルマ から最初の有害事象連絡票が報告される(別ロット)
- 2020 年11月25日:Meiji Seika ファルマから2 例の有害事象連絡票が報告される(「服用した患者で記憶がなくなるという症例が続いた」 という記載、及び服用した小児が「気が狂ったように頭を壁に打ち付けたりしている」という記載あり)▶️厚生労働省への定期報告の対象に
- 2020 年 12月1日:Meiji Seika ファルマから 2 例の副作用が生じたとの有害事象連絡票が報告される(意識消失やふらつき)▶️厚生労働省への定期報告の対象に
- 2020 年 12月2日:小林化工の MR から、1例のめまい症例の報告
- 2020 年 12月3日:Meiji Seika ファルマの MR から四肢の脱力及 び意識レベルの低下の症例が 1 例があったとの有害事象連絡票が報告▶️、製品に問題がある可能性を疑う
- 矢先、Meiji Seika ファルマの MR から、別の病院にて、 イトラコナゾール錠 50mg を服用した患者について一度に 6 例の副作用が発生▶️ロット番号 T0EG08 に品質上の問題がある可能性があると考え、対応を開始
- 2020 年 12月3日21 時:問題となっているロットの製品試験 において初回の試験では含量が規格を下回っていること及び溶出性試験では通常より高い 値が出ていることが確認
- 2020 年 12月3日22 時:ロット番号 T0EG08 に睡眠剤で あるリルマザホン塩酸塩水和物が混入した疑いがあることが判明▶️12 月4日朝までの調査が指示される
- 12月4日8時:緊急会議の実施:て睡眠剤の成分が混入した可能性があり、服用した患者に健康被害が生じる 可能性があることが否定できないためクラス1の自主回収を決定
- 12月4日8時:Meiji Seika ファルマに対して自主回収の方針を伝達
正直、これをみていて対応に問題があった様には感じられませんでした。
過去記事でも紹介しましたが報道後の対応に関しては好意的に受け取れる部分は多いです。

が、一点だけもっと早く対応できただろう?と思うのは緊急会議の実施です。
調査結果の報告を待って実施したと記載がありますが、健康被害という現状を考えれば22時から8時の間により早い意思決定と報道等を活用した服用差しどめが行えれば健康被害を抑えられたのではないか?とはなんとなく思います。
まぁ水面下では動いていたかもしれませんし、社長は夜通し考えてはいそうではありますので、強く言及することは避けます。

直接読んでもらいたい部分
調査報告書の112Pから126Pにかけては是非時間のない方も読んでみて欲しいです。
報告書における原因が端的にまとめられています。
※調査結果報告書

- なぜ混入事故は発生したのか
- なぜ混入は見逃されてしまったのか
- 小林化工経営陣の判断の誤り及び製薬企業経営者としての自覚の欠如
- 製薬企業としての誤ったガバナンス
- GMP 不在の生産拡大
- 小林化工の企業風土について
- 研究開発本部における不適切行為について


最後に:営業としてのキレポイント
最後に私が営業部門だからこそムカついたポイントを紹介して筆をおきます。

「小林化工の医薬品を自信を持って売り歩いている営業本部関係者に対して、実は承認書と製造実態が齟齬しているといった実情を明かすことはできなかった。
研究開発本部、生産本部及び信頼性保証本部関係者の間で、『営業には聞かせられない。』、『われわれだけで収めよう。』と話し合った。
そのた め、営業本部に対しては、『安定的な製造が困難である。』といった別の理由を立てて説 明することにした。」などと述べている
引用:調査結果報告書
生産本部長を務めていた元従業員は、ヒアリングにおいて、「承認書と齟齬した製造を行うことが許されないこ とは分かっていたが、他方で、医薬品の供給責任を果たす必要があった。正直に報告すれ ば、大量の製品が出荷停止となり、供給責任を果たせないと思ったので、軽微届出で対応 できる齟齬だけを報告することにした。」と述べている。
引用:調査結果報告書